

Phân tích CTC đơn bào có thể thực hiện được
.jpg)
Các tế bào ung thư tuần hoàn (CTC) là quần thể tế bào ung thư hiếm gặp, được bắt nguồn từ khối u nguyên phát hoặc khối u di căn và xâm nhập vào máu ngoại vi. Đặc tính phân tử và di truyền của CTC có thể được sử dụng như là một thay thế cho sinh thiết mô xâm lấn. Bất chấp sự cấp bách của lĩnh vực này, các công nghệ phát hiện CTC hiện tại phải đối mặt với nhiều thách thức, hầu hết chúng được kết hợp bởi sự hiện diện của hàng tỷ tế bào máu gây ô nhiễm.
Công nghệ phát hiện CTC thế hệ mới lý tưởng không chỉ thu thập và phân lập CTC từ máu mà còn tương thích với các ứng dụng phân tử đơn dòng, như phân tích miễn dịch, PCR, FISH và NGS. Nền tảng phát hiện CTC tích hợp Celsee™ Diagnostics bao gồm các nền tảng Celsee PREP không chỉ thu các CTC vào các ngăn riêng lẻ trong một con chip vi lỏng mà còn cho phép các xét nghiệm đa phân tử đơn bào trên chip (on-chip single-cell). Cùng với hệ thống hình ảnh Celsee ANALYZER, công nghệ tiên tiến này giúp phân tích tự động các CTC có thể phân tích.
KHÁI QUÁT
Các tế bào ung thư tuần hoàn (CTC) di chuyển khỏi khối u nguyên phát vào máu ngoại vi. Sự định hình phân tử và di truyền của CTC được phân lập từ máu, thường được gọi là sinh thiết lỏng, cung cấp một sự thay thế mạnh mẽ cho sinh thiết mô, gây đau đớn, tốn kém và xâm lấn. Một lợi thế duy nhất của CTC, so với các dấu ấn sinh học dựa trên máu khác như DNA khối u lưu hành (ctDNA), là CTC đại diện cho quần thể tế bào khối u tinh khiết, cung cấp cho các nhà nghiên cứu một công cụ mạnh mẽ để nghiên cứu sự không đồng nhất của ung thư và tiến triển khối u ở các giai đoạn khác nhau. Hơn nữa, các nghiên cứu lâm sàng đã chứng minh tầm quan trọng của CTC như là dấu ấn sinh học để theo dõi di căn, dự đoán đáp ứng điều trị và kết quả điều trị của bệnh nhân trong nhiều bệnh ung thư biểu mô như vú, tuyến tiền liệt, đại tràng và phổi (Cristofanilli, 2005; Cohen et al., 2008).
CTC đã được cộng đồng khoa học biết đến trong hơn một thế kỷ qua (Ashworth, 1869), tuy nhiên, phân tích phân tử của CTC bị giới hạn bởi các công nghệ có sẵn. Mặc dù tiềm năng to lớn của xét nghiệm CTC, việc tìm thấy một vài tế bào trong hàng trăm triệu tế bào máu đại diện cho những thách thức phát triển quan trọng sẽ được thảo luận trong bài báo trắng này.
.jpg)
THÁCH THỨC PHÁT TRIỂN
Độ nhạy: Kim trong vấn đề haystack
Trong máu, số lượng CTC có thể thấp bằng một trong số một tỷ tế bào hồng cầu (RBC) và hàng triệu tế bào bạch cầu (WBC). Ví dụ, WBC vượt trội so với CTC với hệ số ít nhất là 106 (Hou, 2010), khiến cho việc có được một quần thể CTC thuần túy là rất khó khăn. Do đó, các kỹ thuật tách chiết CTC cần phải có độ nhạy cao. Hầu hết các công nghệ phát hiện CTC liên quan đến tiền xử lý toàn bộ máu để loại bỏ RBC. Chúng bao gồm xử lý đệm ly giải RBC hoặc tách gradient mật độ bằng cách ly tâm.
Thật không may, các bước xử lý máu này dẫn đến mất CTC (Yang, 2009).
Hơn nữa, nhiều công nghệ hiện tại dựa vào dấu hiệu miễn dịch đặc hiệu của khối u hoặc biểu mô để chụp CTC ban đầu (Powell et al., 2012). Vấn đề với phương pháp này là không thể xác định tất cả các CTC có trong cùng một bệnh ung thư hoặc ngay cả trong cùng một bệnh nhân do tính không đồng nhất vốn có và sự mất ổn định di truyền của các khối u (Alison, 2010).
Một công nghệ CTC lý tưởng phải đủ nhạy để thu được CTC đơn bào trong một ống máu.
Phân tích đơn bào: Tất cả đều liên quan đến độ phân giải.
Sự định hình phân tử của CTC có khả năng tiết lộ thông tin quan trọng về tình trạng của bệnh và giúp các nhà nghiên cứu hiểu được các sắc thái bệnh. Phân tích đơn bào là rất quan trọng để làm sáng tỏ sự không đồng nhất của ung thư; tuy nhiên, các nhà nghiên cứu tiếp cận rất hạn chế vào các tế bào này để tiến hành mô tả đặc tính xuôi dòng.
Trong nhiều protocol hiện tại có sự mất tế bào trong quá trình làm giàu, và sau đó các WBC gây ô nhiễm còn lại làm tắc nghẽn tín hiệu, cản trở việc làm sáng tỏ. Rất ít hệ thống có độ phân giải để trực quan hóa và phân tích đơn bào do những hạn chế kỹ thuật.
Một nền tảng CTC lý tưởng nên có độ phân giải để trực quan hóa và phân tích đơn bào.
Thiết kế quy trình làm việc: Ảnh hưởng đến việc áp dụng
Tốc độ phát triển của các công nghệ và phương pháp mới để phát hiện CTC không trùng khớp với việc áp dụng và xác nhận do thiếu độ tin cậy và khả năng tái tạo hệ thống. Nền tảng CTC thế hệ mới lý tưởng nên được tự động hóa và áp dụng trong các phòng thí nghiệm bệnh lý truyền thống được sử dụng để xử lý các mô khối u trên các phiến kính. Các phòng thí nghiệm này yêu cầu một hệ thống không làm gián đoạn quy trình làm việc đã thiết lập của họ. Hầu hết các công nghệ CTC có sẵn trên thị trường chỉ cho phép làm giàu và / hoặc đếm các CTC, mà không phân tích các phân tử của các tế bào. Các phòng thí nghiệm liên quan đến nghiên cứu ung thư cần một hệ thống kết quả mẫu, có thể được xác nhận.
“Khả năng nắm bắt và đặc trưng chức năng của các tế bào ung thư tuần hoàn là rất quan trọng đối với sự phát triển của các xét nghiệm chẩn đoán và tiên lượng thế hệ mới cho phép đưa ra quyết định cho bệnh nhân”. Ken Pienta, M.D., Viện tiết niệu James Congannan Brady, Bệnh viện Johns Hopkins
HỆ THỐNG PHÂN TÍCH TỔNG HỢP CTC CELSEE DIAGNOSTICS
Hệ thống phân tích tổng hợp CTC Celsee Diagnostics bao gồm Celsee PREP400 được cấp bằng sáng chế và trạm hình ảnh Celsee ANALYZER. Celsee PREP400 được thiết kế nhã nhặn, nắm bắt, đếm và thực hiện phân tích đơn bào CTC trực tiếp từ máu toàn phần. Sau đó, trạm hình ảnh Celsee ANALYZER sẽ tự động chụp các trường sáng và / hoặc hình ảnh huỳnh quang của các CTC được chụp; phần mềm độc quyền cho phép định lượng hình ảnh cụ thể và tạo báo cáo. Cả hai thiết bị này làm cho phân tích tự động của CTC có thể thực hiện được.
.jpg)
Celsee PREP400 tự động hóa tất cả các bước để tách, đếm và phân tích CTC cho phép nhân viên phòng thí nghiệm khả năng tải mẫu thử và bỏ đi; xử lý mẫu theo kết quả.
Trung tâm của nền tảng Celsee PREP là một con chip vi lỏng (microfluidic) được cấp bằng sáng chế có thể thu giữ và phân lập CTC khỏi máu dựa trên sự khác biệt về kích thước và độ biến dạng của chúng so với tế bào máu. Ngoài việc bơm mẫu máu tự động và có kiểm soát thông qua chip vi lỏng, hệ thống chuẩn bị mẫu cũng tự động hóa, tất cả các chất lỏng được phân phối từ một hộp chất phản ứng. Celsee PREP400 có thể chạy tới bốn mẫu. Tất cả các bước cần thiết để làm giàu và mô tả đặc điểm của CTC trước khi chụp ảnh được thực hiện không cần dùng tay, giảm lỗi vận hành, tăng độ tái lập và độ tin cậy.
Nền tảng Celsee PREP làm mờ nền WBC bằng cách tách tế bào bị thu giữ vào các buồng riêng của chúng và cho phép phân tích miễn dịch trên chip, phân tích DNA FISH và RNA FISH của CTC.
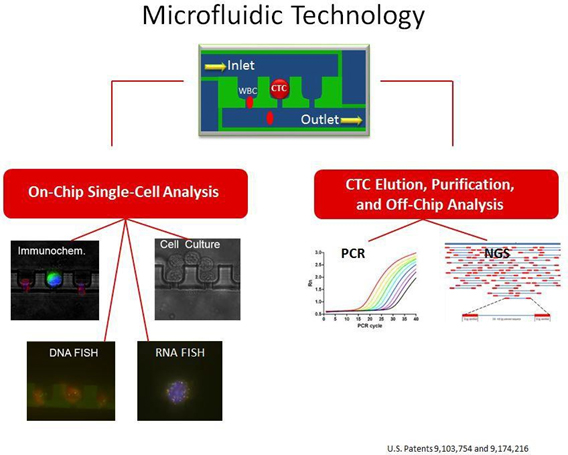
Chỉ cần 2 ml máu toàn phần được xử lý thông qua chip vi lỏng và quá trình này mất khoảng 6 phút để hoàn thành.
Chip vi lỏng (microfluidic) bao gồm 56.400 buồng chụp đảm bảo mỗi CTC bị bắt giữ được tách trong ngăn riêng của nó cho phép phân tích tế bào và bộ gen được thực hiện ở cấp độ đơn bào. Một số WBC nền có thể không đi qua buồng vào bình chứa chất thải và bị giữ lại trong các buồng riêng biệt tách biệt với các CTC bị bắt giữ. Các tế bào này nhanh chóng được xác định bởi CD45, một điểm đánh dấu WBC. Các protocols trên chip có sẵn để phân tích miễn dịch, phân tích DNA FISH và RNA FISH. CTC cũng có thể được rửa giải để phân tích, nuôi cấy và phân tích ngoài chip như PCR và giải trình tự thế hệ mới (NGS).

Máu toàn phần pha loãng với đệm được xử lý thông qua chip vi lỏng được cấp bằng sáng chế..
.
Các bước xử lý mẫu trước khi làm giàu CTC dẫn đến mất tế bào đích. Nền tảng Celsee PREP giải quyết vấn đề đó bằng cách xử lý máu toàn phần được pha loãng với bộ đệm thông qua chip vi lỏng. Không yêu cầu các bước tiền xử lý ly tâm hoặc ly giải tế bào. Hệ thống khép kín này cung cấp một trong những độ nhạy cao nhất của chụp CTC hiện có.
Đi kèm với hệ thống chuẩn bị mẫu là trạm hình ảnh Celsee ANALZYER, tự động quét hình ảnh của các tế bào đã chụp, cả trong trường sáng và trong huỳnh quang (tối đa 5 màu). Phần mềm khóa vị trí của các tế bào để tham khảo trong tương lai thông qua công nghệ GPS microfluidic độc quyền được kích hoạt bằng cách đặt mã zip độc đáo được chế tạo trên toàn bộ chip vi lỏng. Phần mềm cũng cho phép định lượng hình ảnh, phân tích và tạo báo cáo.

Trạm hình ảnh Celsee ANALYZER tự động quét tối đa tám chip, chụp ảnh của các CTC đã được tách. Các tế bào quan trọng có thể được xem xét nhanh chóng về tính không đồng nhất, cấu trúc tế bào và bộ gen của chúng khi mỗi CTC được xác định, chụp ảnh và phân loại vị trí.
Hiệu quả bắt giữ 85%
Hiệu quả của Celsee PREP400 được tìm thấy là lớn hơn 85% trong các thí nghiệm về tế bào ung thư. Celsee Diagnostics đã xác nhận nền tảng Celsee PREP với các dòng tế bào ung thư ở người: MCF7 (vú), SKBR3 (vú), LnCAP (tuyến tiền liệt), PC3 (tuyến tiền liệt) và HT29 (đại trực tràng) (Riahi, et al., 2014). Ngoài ra, các nhà nghiên cứu lâm sàng đã quan sát và đếm các CTC trong các mẫu lâm sàng ung thư tuyến tiền liệt, đại trực tràng và vú trên nền tảng Celsee.
Những phát hiện của một nghiên cứu ung thư vú lâm sàng được thực hiện tại Trung tâm Ung thư Sidney Kimmel (SKCC), Đại học Thomas Jefferson, (Paolillo, et al., 2015), cho thấy kết quả nền tảng tế bào khối u (CTC) của Celsee Diagnostics phù hợp với Nền tảng chẩn đoán CELLSEARCH® FDA-cleared từ Janssen Diagnostics, LLC.
Công nghệ “Celsee Diagnostics"giúp chúng tôi không chỉ đếm mà còn chuyển sang phân tích CTC phân tử. Hệ thống vi lỏng mới cho thấy tính chính xác và linh hoạt và có tiềm năng trở thành một phương pháp thay thế khả thi và thông tin cho các phương pháp hiện có”. , Phòng thí nghiệm genom ung thư, Trung tâm ung thư Sidney Kimmel, Đại học Thomas Jefferson
Nghiên cứu được thực hiện trên 31 bệnh nhân ung thư vú di căn được đăng ký từ tháng 3 đến tháng 6 năm 2014. Phát hiện CTC bởi nền tảng vi lỏng Celsee có liên quan tích cực hơn với bệnh nhân HER2 dương tính so với hệ thống CELLSEARCH. Hai phương pháp này phù hợp với nhau 84% (k = 0,678) khi cắt ≥ 5 tế bào trên 7,5 ml máu được sử dụng để xác định bệnh nhân có nguy cơ tiến triển bệnh cao hơn.
“Là một bác sĩ lâm sàng, chúng tôi mong muốn có thể phân tích các CTC ở cấp độ phân tử. Thông tin đó có thể giúp tiết lộ cơ hội điều trị hiệu quả ở bệnh nhân.” Tiến sĩ Massimo Cristofanilli, Giám đốc Trung tâm Chăm sóc vú Jefferson, người đã nghiên cứu thiết lập giá trị tiên lượng của CTC năm 2004 (Cristofanilli, et al., 2004).
PHÁT TRIỂN ỨNG DỤNG NGHIÊN CỨU CỦA RIÊNG BẠN
Hệ thống Celsee PREP100 hiệu quả về chi phí được thiết kế cho các mẫu riêng lẻ bao gồm các chức năng tương tự của Celsee PREP400 cho bốn mẫu với các nhà nghiên cứu cần vết nhỏ hơn, thích hợp chạy các mẫu riêng lẻ và phát triển các thử nghiệm riêng của họ. Hệ thống này có khả năng thực hiện hóa mô miễn dịch trên chip, xét nghiệm DNA FISH và RNA FISH, và là một giải pháp thay thế hiệu quả về chi phí để tiến hành nghiên cứu tiên tiến về CTC. Ngoài ra, các mẫu có thể được chạy và một dòng chảy ngược được thực hiện để tạo ra một quần thể tế bào được làm giàu cho các ứng dụng tiếp theo, chẳng hạn như PCR và NGS.

Celsee PREP100 được thiết kế đặc biệt cho môi trường nghiên cứu ung thư. Với kiến trúc mở của nó, các nhà nghiên cứu có thể tùy chỉnh các thí nghiệm trên các CTC bị cô lập giúp giảm thời gian phát hiện
KẾT LUẬN
Celsee Diagnostics cung cấp bộ dụng cụ sẵn có ở định dạng tám hoặc hai mươi mẫu để sử dụng với nền tảng Celsee PREP. Tất cả các vật tư tiêu hao độc quyền được bao gồm, chẳng hạn như chip vi lỏng, phễu đầu vào, bình chất thải và ống, cũng như thuốc thử, như đệm, thuốc thử cố định và kháng thể.
Các thuốc thử Celsee CTC Immunochemistry Kit bao gồm Pan-CK, kháng thể CD45 và vết hạt nhân DAPI. Celsee CTC Kit không chứa kháng thể và cho phép người dùng sử dụng thuốc thử đặc trưng của riêng họ. Bộ làm giàu Celsee CTC bao gồm tất cả các thành phần cần thiết để thu thập và truy xuất tế bào cho các ứng dụng tiếp theo, chẳng hạn như NGS và PCR.
TÀI LIỆU THAM KHẢO
1. Ashworth, T.R. "A Case of Cancer in Which Cells Similar to Those in the Tumours Were Seen in the Blood after Death." Aust Med 14 (1869): 146-49.
2. Alison, A.L., Keeney M. "Circulating Tumor Cell Analysis: Technical and Statistical Considerations for Application to the Clinic." Journal of Oncology (2010):1-10.
3. Cohen, S.J., Punt, C.J.A., Iannotti, N., Saidman, B.H., Sabbath, K.D., Gabrail, N.Y., Picus, J., Morse, M., Mitchell, E., Miller, M.C., Doyle, G.V., Tissing, H., Terstappen, L.W.M.M. and Meropol,
N.J. "Relationship of Circulating Tumor Cells to Tumor Response, Progression-Free Survival, and Overall Survival in Patients with Metastatic Colorectal Cancer." Journal of Clinical Oncology 26.19 (2008): 3213-221.
4. Cristofanilli, M., Budd, G.T., Ellis, M.J., Stopeck, A., Matera, J., Miller, M.C., Reuben, J.M., Doyle, G.V., Allard, W.J., Terstappen, L.W.M.M., and Hayes, D.F. “Circulating Tumor Cells, Disease Progression, and Survival in Metastatic Breast Cancer”N Engl J Med (2004): 351:781-791. DOI: 10.1056/NEJMoa040766.
5. Cristofanilli, M. "Circulating Tumor Cells: A Novel Prognostic Factor for Newly Diagnosed Metastatic Breast Cancer." Journal of Clinical Oncology 23.7 (2005): 1420-430.
6. Hou, J.M, Krebs M., Ward T., Morris K., Sloane R., Blackhall F., Dive C. “Circulating Tumor Cells, Enumeration and Beyond.”Cancers. (2010): 2(2):1236-1250.
7. Paolillo, C., Mu, Z., Toss, A., Gogoi, P., Sepehri, S., Zhou, Y., Handique, K., Zhong, Y., Yang, H., Capoluongo, E., Cristofanilli, M. and Fortina, P. “A novel microfluidic system for the detection, enumeration and molecular analysis of circulating tumor cells (CTCs) in metastatic breast cancer (MBC)”Cancer Res (2015): 75; P4-01-2. DOI: 10.1158/1538-7445.SABCS14-P4-01-20.
8. Powell, A.A., Talasaz, A.H, Zhang, H., Coram, M.A., Reddy, A., Deng, G., Telli, M., Advani, R., Carlson, R.W., Mollick, J.A., Sheth, S., Kurian, A.W., Ford, J.M., Stockdale, F.E., Quake, S.R., Pease, F., Mindrinos, M.N., Bhanot, G., Dairkee, S.H., Ronald W., Davis, R.W. and Jeffrey, S.S. "Single Cell Profiling of Circulating Tumor Cells: Transcriptional Heterogeneity and Diversity from Breast Cancer Cell Lines." PLoS One (2012): E33788. 7.5.
9. Riahi, R., Gogoi, P., Sepehri, S., Zhou, Y., Handique, K., Godsey, J, and Wang, X. “A novel microchannel-based device to capture and analyze circulating tumor cells (CTCs) of breast cancer.” Int J Oncol. (2014):44(6):1870-8. DOI: 10.3892/ijo.2014.2353.
10. Yang, L., Lang, J.C., Balasubramanian, P., Jatana, K.R., Schuller, D., Agrawal, A., Zborowski, M. and Chalmers, J.J. “Optimization of an enrichment process for circulating tumor cells from the blood of head and neck cancer patients through depletion of normal cells.”Biotechnol. Bioeng. (2009): 102: 521–534. DOI: 10.1002/bit.22066.

CapitalBio Technology
Building C, 88 Kechuang 6th Street YiZhuang Biomedical Park,BDA Beijing.
Tel:010-69002900-8817 Fax:010-69002988
Web: www.capitalbiotech.com